INTRODUCCIÓN
GASES
En el siguiente informe recordaremos lo que es un gas y como se relaciona con la presion, temperatura y volumen, creando asi las diferentes leyes que pndremos en praactica con dferentes ejercicios que nos ofrece una pagina web.
OBJETIVOS
- Diferenciar un gas entre los demás estados de la materia (liquido y solido).
- Comprender la relación entre volumen, temperatura y presión de un gas.
- Reconocer cada una de las leyes de los gases.
- Lograr resolver cada ejercicio planteado.
GASES
Tanto las moléculas de los gases como la de los líquidos, presentan la propiedad de deslizarse de manera continua, con lo cual cambian frecuentemente sus posiciones relativas; por esta razón se le denomina fluidos.
Las partículas se mueven con mayor libertad en el estado gaseoso que en los otros dos estados en que regularmente se presenta la materia.
1. VOLUMEN:
Es el espacio ocupado por un cuerpo. Como un gas se expande espontáneamente ocupando totalmente el recipiente que lo contiene, el volumen ocupado por un gas es la capacidad del recipiente que lo contiene. La unidad SI patrón de volumen es el metro cubico (m3), una unidad bastante grande. Un decimentro cubico (dm3), es una unidad de volumen mas conveniente para nuestros objetivos. Aunque generalmente se le da otro nombre: Litro. Para volúmenes mas pequeños, usaremos centímetro cubico (cm3), o el mililitro, que son aproximadamente iguales.
 Mide la intensidad de calor, para lo cual se tiene en cuenta propiedades como la dilatación térmica. La temperatura de los gases se mide generalmente en grados centigrados (°C). Cuando se aplican las leyes de los gase ideales, esta temperatura (centigrada) debe convertirse a la escala absoluta que es la temperatur Kelvin (°K), asi:
Mide la intensidad de calor, para lo cual se tiene en cuenta propiedades como la dilatación térmica. La temperatura de los gases se mide generalmente en grados centigrados (°C). Cuando se aplican las leyes de los gase ideales, esta temperatura (centigrada) debe convertirse a la escala absoluta que es la temperatur Kelvin (°K), asi:
1. VOLUMEN:
Es el espacio ocupado por un cuerpo. Como un gas se expande espontáneamente ocupando totalmente el recipiente que lo contiene, el volumen ocupado por un gas es la capacidad del recipiente que lo contiene. La unidad SI patrón de volumen es el metro cubico (m3), una unidad bastante grande. Un decimentro cubico (dm3), es una unidad de volumen mas conveniente para nuestros objetivos. Aunque generalmente se le da otro nombre: Litro. Para volúmenes mas pequeños, usaremos centímetro cubico (cm3), o el mililitro, que son aproximadamente iguales.
2. PRESIÓN:
Es la fuerza ejercida por unidad de área. En los gases, esta fuerza actúa en forma uniforme sobre todas las partes del recipiente. Sin embargo, en química, para expresar presiones de gases, se usa la atmósfera estándar y URel milímetro de mercurio o torr.
Los gases, por tener peso, producen presiones sobre los cuerpos, de modo que estas presiones se manifiestan en todas las direcciones. A la presión que actúa sobre los cuerpos existentes de la tierra, por estar en la atmósfera, la denominamos presión atmosférica. Se origina el peso del aire que la forma.Mientras mas alto se halle un cuerpo, menos capaz de aire hay por encima de él.
3. TEMPERATURA:
 Mide la intensidad de calor, para lo cual se tiene en cuenta propiedades como la dilatación térmica. La temperatura de los gases se mide generalmente en grados centigrados (°C). Cuando se aplican las leyes de los gase ideales, esta temperatura (centigrada) debe convertirse a la escala absoluta que es la temperatur Kelvin (°K), asi:
Mide la intensidad de calor, para lo cual se tiene en cuenta propiedades como la dilatación térmica. La temperatura de los gases se mide generalmente en grados centigrados (°C). Cuando se aplican las leyes de los gase ideales, esta temperatura (centigrada) debe convertirse a la escala absoluta que es la temperatur Kelvin (°K), asi:
T = t + 273
K = 0 ° C + 273
T = temperatura absoluta
t = temperatura centigrada
LEYES DE LOS GASES
 Al aumentar el volumen, las partículas (átomos o moléculas) del gas tardan más en llegar a las paredes del recipiente y por lo tanto chocan menos veces por unidad de tiempo contra ellas. Esto significa que la presión será menor ya que ésta representa la frecuencia de choques del gas contra las paredes.
Al aumentar el volumen, las partículas (átomos o moléculas) del gas tardan más en llegar a las paredes del recipiente y por lo tanto chocan menos veces por unidad de tiempo contra ellas. Esto significa que la presión será menor ya que ésta representa la frecuencia de choques del gas contra las paredes.
 Cuando aumentamos la temperatura del gas las moléculas se mueven con más rapidez y tardan menos tiempo en alcanzar las paredes del recipiente. Esto quiere decir que el número de choques por unidad de tiempo será mayor. Es decir se producirá un aumento (por un instante) de la presión en el interior del recipiente y aumentará el volumen (el émbolo se desplazará hacia arriba hasta que la presión se iguale con la exterior).
Cuando aumentamos la temperatura del gas las moléculas se mueven con más rapidez y tardan menos tiempo en alcanzar las paredes del recipiente. Esto quiere decir que el número de choques por unidad de tiempo será mayor. Es decir se producirá un aumento (por un instante) de la presión en el interior del recipiente y aumentará el volumen (el émbolo se desplazará hacia arriba hasta que la presión se iguale con la exterior).
T
3. LEY DE GAY - LUSSAC
Fue enunciada por Joseph Louis Gay-Lussac a principios de 1800.
Establece la relación entre la temperatura y la presión de un gas cuando el volumen es constante.
¿POR QUÉ OCURRE ESTO?
 Al aumentar la temperatura las moléculas del gas se mueven más rápidamente y por tanto aumenta el número de choques contra las paredes, es decir aumenta la presión ya que el recipiente es de paredes fijas y su volumen no puede cambiar.
Al aumentar la temperatura las moléculas del gas se mueven más rápidamente y por tanto aumenta el número de choques contra las paredes, es decir aumenta la presión ya que el recipiente es de paredes fijas y su volumen no puede cambiar.
Gay-Lussac descubrió que, en cualquier momento de este proceso, el cociente entre la presión y la temperatura siempre tenía el mismo valor:
Esta ley, al igual que la de Charles, está expresada en función de la temperatura absoluta. Al igual que en la ley de Charles, las temperaturas han de expresarse en Kelvin.
4. LEY COMBINADA DE LOS GASES
 La ley general de los gases o ley combinada dice que una masa de un gas ocupa un volumen que está determinado por la presión y la temperatura de dicho gas. Estudia el comportamiento de una determinada masa de gas si ninguna de esas magnitudes permanece constante.
La ley general de los gases o ley combinada dice que una masa de un gas ocupa un volumen que está determinado por la presión y la temperatura de dicho gas. Estudia el comportamiento de una determinada masa de gas si ninguna de esas magnitudes permanece constante.
Esta ley se emplea para todos aquellos gases ideales en los que el volumen, la presión y la temperatura no son constantes. Además la masa no varía. La fórmula de dicha ley se expresa:
V1 * P1 / T1 = V2 * P2 / T2
Es decir, el volumen de la situación inicial por la presión original sobre la temperatura es igual a el volumen final por la nueva presión aplicada sobre la temperatura modificada.
La presión es una fuerza que se ejerce por la superficie del objeto y que mientras más pequeña sea ésta, mayor presión habrá.
A partir de la ley combinada podemos calcular la forma como cambia el volumen o presión o temperatura si se conocen las condiciones iniciales (Pi,Vi,Ti) y se conocen dos de las condiciones finales (es decir, dos de las tres cantidades Pt, Vt, Tf).
PROCEDIMIENTO
1. LEY DE BOYLE O MARIOTTE
Fue descubierta por Robert Boyle en 1662. Edme Mariotte también llegó a la misma conclusión que Boyle, pero no publicó sus trabajos hasta 1676. Esta es la razón por la que en muchos libros encontramos esta ley con el nombre de Ley de Boyle y Mariotte.
La ley de Boyle establece que la presión de un gas en un recipiente cerrado es inversamente proporcional al volumen del recipiente, cuando la temperatura es constante.
¿POR QUÉ OCURRE ESTO?
Cuando disminuye el volumen la distancia que tienen que recorrer las partículas es menor y por tanto se producen más choques en cada unidad de tiempo: aumenta la presión.
Lo que Boyle descubrió es que si la cantidad de gas y la temperatura permanecen constantes, el producto de la presión por el volumen siempre tiene el mismo valor.
Como hemos visto, la expresión matemática de esta ley es: P⋅V=k
Supongamos que tenemos un cierto volumen de gas V1 que se encuentra a una presión P1 al comienzo del experimento. Si variamos el volumen de gas hasta un nuevo valor V2, entonces la presión cambiará a P2, y se cumplirá:
P1⋅V1=P2⋅V2
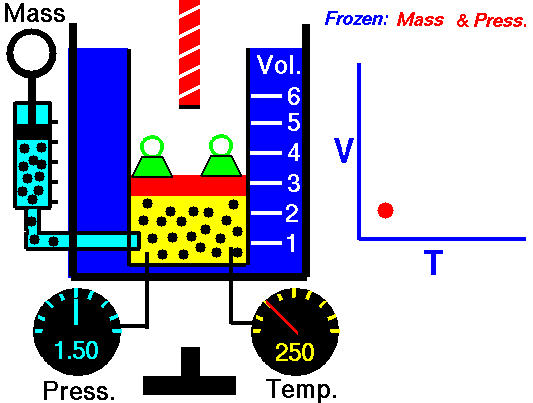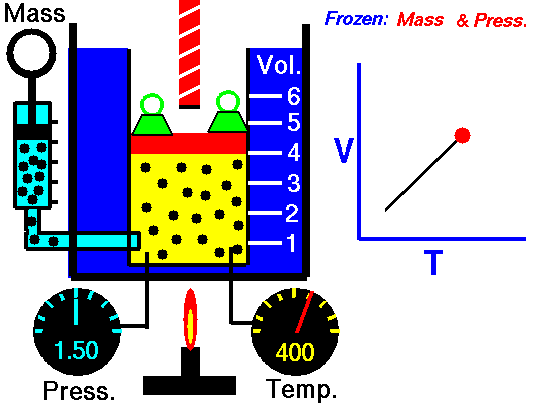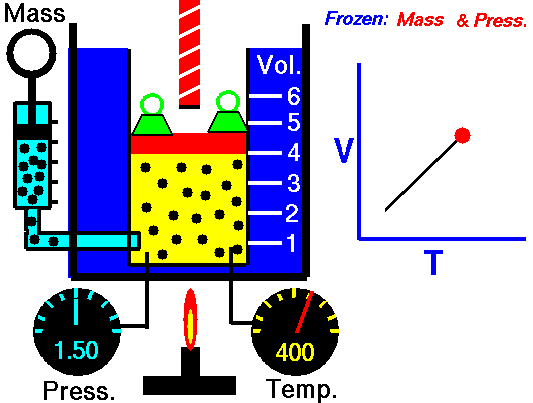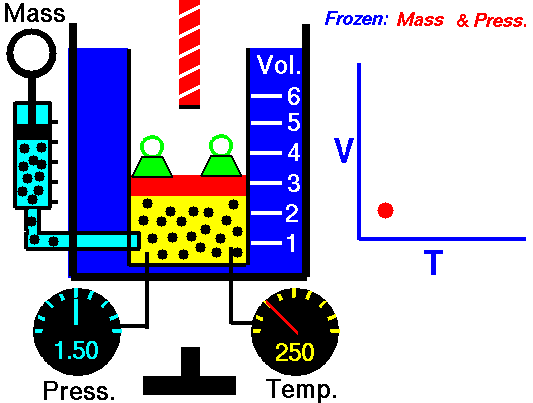
2. LEY DE CHARLES
En 1787, Jack Charles estudió por primera vez la relación entre el volumen y la temperatura de una muestra de gas a presión constante y observó que cuando se aumentaba la temperatura el volumen del gas también aumentaba y que al enfriar el volumen disminuía.
¿POR QUÉ OCURRE ESTO?
 Cuando aumentamos la temperatura del gas las moléculas se mueven con más rapidez y tardan menos tiempo en alcanzar las paredes del recipiente. Esto quiere decir que el número de choques por unidad de tiempo será mayor. Es decir se producirá un aumento (por un instante) de la presión en el interior del recipiente y aumentará el volumen (el émbolo se desplazará hacia arriba hasta que la presión se iguale con la exterior).
Cuando aumentamos la temperatura del gas las moléculas se mueven con más rapidez y tardan menos tiempo en alcanzar las paredes del recipiente. Esto quiere decir que el número de choques por unidad de tiempo será mayor. Es decir se producirá un aumento (por un instante) de la presión en el interior del recipiente y aumentará el volumen (el émbolo se desplazará hacia arriba hasta que la presión se iguale con la exterior).
Lo que Charles descubrió es que si la cantidad de gas y la presión permanecen constantes, el cociente entre el volumen y la temperatura siempre tiene el mismo valor.
Matemáticamente podemos expresarlo así: P/T = K
T
Supongamos que tenemos un cierto volumen de gas V1 que se encuentra a una temperatura T1 al comienzo del experimento. Si variamos el volumen de gas hasta un nuevo valor V2, entonces la temperatura cambiará a T2, y se cumplirá:
V1/T1=V2/T2
Esta ley se descubre casi ciento cuarenta años después de la de Boyle debido a que cuando Charles la enunció se encontró con el inconveniente de tener que relacionar el volumen con la temperatura Celsius ya que aún no existía la escala absoluta de temperatura.
3. LEY DE GAY - LUSSAC
Fue enunciada por Joseph Louis Gay-Lussac a principios de 1800.
Establece la relación entre la temperatura y la presión de un gas cuando el volumen es constante.
¿POR QUÉ OCURRE ESTO?
 Al aumentar la temperatura las moléculas del gas se mueven más rápidamente y por tanto aumenta el número de choques contra las paredes, es decir aumenta la presión ya que el recipiente es de paredes fijas y su volumen no puede cambiar.
Al aumentar la temperatura las moléculas del gas se mueven más rápidamente y por tanto aumenta el número de choques contra las paredes, es decir aumenta la presión ya que el recipiente es de paredes fijas y su volumen no puede cambiar.Gay-Lussac descubrió que, en cualquier momento de este proceso, el cociente entre la presión y la temperatura siempre tenía el mismo valor:
P / T = k
Supongamos que tenemos un gas que se encuentra a una presión P1 y a una temperatura T1 al comienzo del experimento. Si variamos la temperatura hasta un nuevo valor T2, entonces la presión cambiará a P2, y se cumplirá:
P1 / T1 = P2 / T2
Esta ley, al igual que la de Charles, está expresada en función de la temperatura absoluta. Al igual que en la ley de Charles, las temperaturas han de expresarse en Kelvin.
4. LEY COMBINADA DE LOS GASES
Esta ley se emplea para todos aquellos gases ideales en los que el volumen, la presión y la temperatura no son constantes. Además la masa no varía. La fórmula de dicha ley se expresa:
V1 * P1 / T1 = V2 * P2 / T2
Es decir, el volumen de la situación inicial por la presión original sobre la temperatura es igual a el volumen final por la nueva presión aplicada sobre la temperatura modificada.
La presión es una fuerza que se ejerce por la superficie del objeto y que mientras más pequeña sea ésta, mayor presión habrá.
A partir de la ley combinada podemos calcular la forma como cambia el volumen o presión o temperatura si se conocen las condiciones iniciales (Pi,Vi,Ti) y se conocen dos de las condiciones finales (es decir, dos de las tres cantidades Pt, Vt, Tf).
PROCEDIMIENTO


INCOMPLETO NO SIGUIO EL DERROTERO ACORDADO 3.0
ResponderEliminar