INTRODUCCIÓN
La tabla periódica explica en forma detallada y actualizada las propiedades de los elementos químicos, tomando como base a su estructura atómica.Según sus propiedades químicas, los elementos se clasifican en metales y no metales. Hay más elementos metálicos que no metálicos. En el siguiente informe se explicaran los grupos 4, 5, 6 y 7 de la tabla periódica, aunque existen 18 grupos nos enfocaremos en estos cuatro con sus principales características, luego indagaremos sobre cada uno de los elementos que conforman estos grupos y sus principales características.
OBJETIVOS
1. Identificar los elementos de los grupos 4, 5, 6 y 7 de la tabla periódica.
2. Conocer las características que distinguen a cada grupo.
3. Indagar sobre cada uno de los elementos.
4. Distinguir cada grupo.
MARCO TEÓRICO
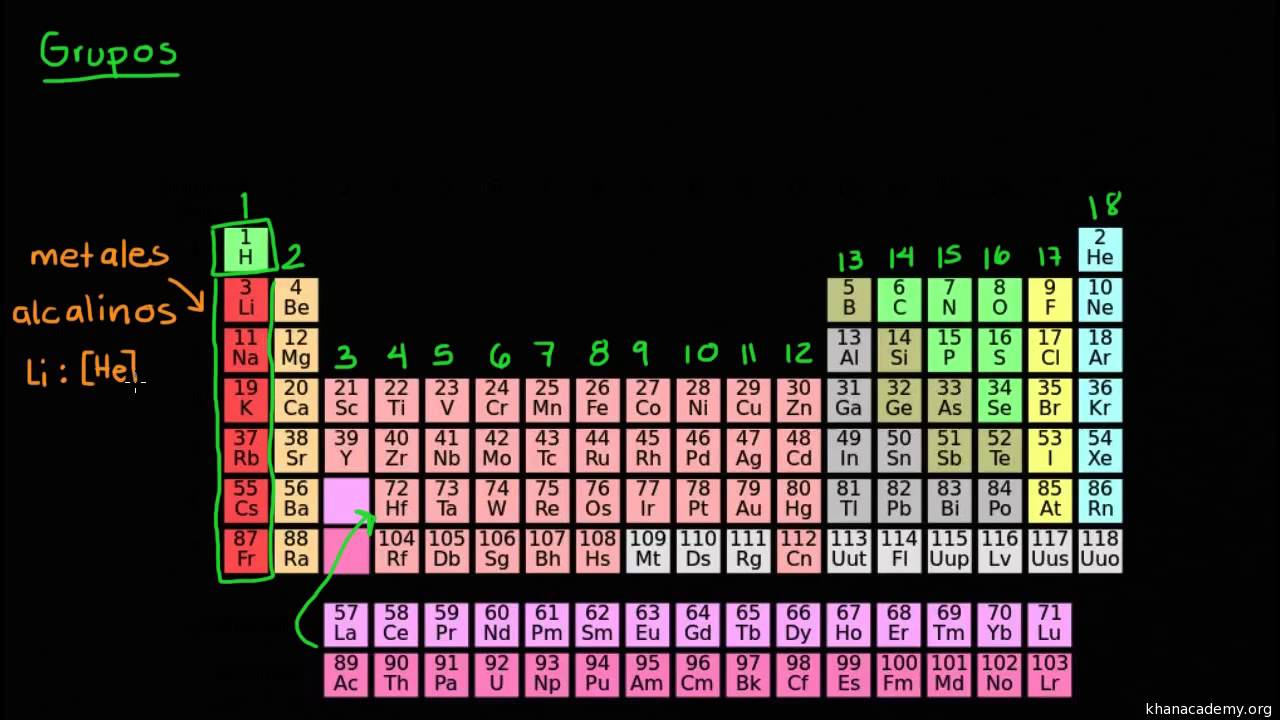
 Un grupo es una columna de la tabla periódica de los elementos. Hay 18 grupos en la tabla periódica estándar. En la tabla periódica los elementos conocidos hasta el momento se clasifican en orden según su número atómico, con una estructura de dieciocho columnas, y siete filas. A las filas se las conoce como períodos, y a las columnas, como grupos.
Un grupo es una columna de la tabla periódica de los elementos. Hay 18 grupos en la tabla periódica estándar. En la tabla periódica los elementos conocidos hasta el momento se clasifican en orden según su número atómico, con una estructura de dieciocho columnas, y siete filas. A las filas se las conoce como períodos, y a las columnas, como grupos.
Los elementos conocidos como, representativos, forman los grupos de número 1,2 y del 13 al 18. Estos grupos a menudo reciben nombres especiales:
Grupo nº 1: Alcalinos, configuración electrónica, ns^1
Grupo nº 2: Alcalinotérreos, configuración electrónica, ns^2
Grupo nº 16: Calcógenos, configuración electrónica, ns^2 np^4
Grupo nº17: Halógenos, configuración electrónica, ns^2 np^5
Grupo nº18: Gases nobles, configuración electrónica, ns^2 np^6
El resto de los grupos se denominan:
Grupo 3: Familia del Escandio
Grupo 4: Familia del Titanio
Grupo 6: Familia del Cromo
Grupo 7: Familia del Manganeso
Grupo 8: Familia del Hierro
Grupo 9: Familia del Cobalto
Grupo 10: Familia del Níquel
Grupo 11: Familia del Cobre
Grupo 12: Familia del Zinc
Grupo 13: Térreos
Grupo 14: Carbonoideos
Grupo 15: Nitrogenoides
GRUPO NUMERO 4

El grupo de carbono es un grupo de la tabla periódica integrado por los elementos: carbono (C), silicio (Si), germanio (Ge), estaño (Sn), plomo (Pb) En la notación moderna de la IUPAC se lo llama Grupo 14. En el campo de la física de los semiconductores, todavía es universalmente llamado Grupo IV.
Al igual que otros grupos, los miembros de esta familia poseen similitudes en su configuración electrónica, ya que poseen la misma cantidad de electrones en el último nivel o subnivel de energía. Eso explica las similitudes en sus comportamientos químicos.
Características:
1. Cada uno de los elementos de este grupo tiene 4 electrones en su capa más externa.
2. En la mayoría de los casos, los elementos comparten sus electrones; la tendencia a perder electrones aumenta a medida que el tamaño del átomo aumenta.
3. Los puntos de ebullición en el grupo IVA tienden a disminuir a medida que se desciende en el grupo.
CARBONO:
Símbolo: C
Numero atómico: 6
Es un elemento sólido a temperatura ambiente. Es el pilar básico de la química orgánica; se conocen cerca de 16 millones de compuestos de carbono, aumentando este número en unos 500.000 compuestos por año, y forma parte de todos los seres vivos conocidos. Forma el 0,2 % de la corteza terrestre.
Características:
1. Es un elemento no metálico y es conductor de la electricidad.
2. En la naturaleza, sin embargo, se presenta en seis formas distintas o alótropos.
3. La química del carbono es conocida como la química de la vida, ya que los seres vivos conocidos hasta la fecha tienen como base estructuras moleculares fundamentadas en el carbono.
4. En su altísima capacidad de combinación, el carbono se encuentra también en numerosas sustancias inorgánicas.
5. Mención aparte merecen los hidrocarburos, sustancias compuestas a partir de átomos de hidrógeno y carbono. Estas sustancias están vinculadas con la vida.
SILICIO:
Símbolo: Si
El silicio es el segundo elemento más abundante de la corteza terrestre (27,7% en peso) Se presenta en forma amorfa y cristalizada; el primero es un polvo parduzco, más activo que la variante cristalina, que se presenta en octaedros de color azul grisáceo y brillo metálico.
Características:
1.Presenta un color grisáceo.
2. El silicio es un metaloide, un elemento con propiedades intermedias entre los metales y los no metales.
3. Es sólido a temperatura ambiente.
4. Este elemento existe en dos formas alotrópicas: una de ellas es en forma de cristales, de color negro grisáceo. La otra forma alotrópica no tiene una estructura cristalina y se la encuentra como un polvo color castaño.
5. Es un elemento semiconductor de la electricidad y del calor.
6. En su forma cristalina es muy duro y poco soluble.
7. Presenta un leve brillo metálico.
8. No es tóxico.
GERMANIO:
Símbolo: Ge
Numero atómico: 32
El germanio se encuentra muy distribuido en la corteza terrestre con una abundancia de 6.7 partes por millon (ppm). El germanio tiene una apariencia metálica, pero exhibe las propiedades físicas y químicas de un metal sólo en condiciones especiales, dado que está localizado en la tabla periódica en donde ocurre la transición de metales a no metales.
Caracteristicas:
1. El germanio conserva su brillo cuando se somete a temperaturas ordinarias.
2. Resiste a los ácidos y álcalis.
3. El germanio tiene una masa atómica de 72,64 u.
4. Hace parte de un gran número de compuestos organometálicos.
5. El germanio forma dos hidruros: GeH4 y Ge2H6.
https://quimica.laguia2000.com/general/grupos-de-la-tabla-periodica
http://enciclopedia.us.es/index.php/Grupo_de_la_tabla_peri%C3%B3dica




JUEGO 5,0
ResponderEliminarGRUPOS LE FALTARON 5,6,7 2,5
DEFI NITIVA 3,7